市场监管总局根据《保健食品原料目录和保健功能目录管理办法》,组织制定了《保健食品新功能技术评价实施细则(试行)(征求意见稿)》,现面向社会公开征求意见,意见建议反馈截止时间为2022年9月1日。公众可以通过以下途径和方式提出意见建议:
一、登录市场监管总局网站(网址:http://www.samr.gov.cn),通过首页“互动”栏目中的“征集调查”提出意见。
二、通过电子邮件将意见建议发送至:bjspbjgn@cfe-samr.org.cn,邮件主题请注明“《保健食品新功能技术评价实施细则(试行)(征求意见稿)》公开征集意见”字样。
三、将意见建议邮寄至:北京市西城区北露园1号国家市场监督管理总局特殊食品司,并在信封上注明“《保健食品新功能技术评价实施细则(试行)(征求意见稿)》公开征集意见”字样。
附件:保健食品新功能技术评价实施细则(试行)(征求意见稿)
市场监管总局
2022年8月2日
附件:
保健食品新功能技术评价实施细则(试行)
(征求意见稿)
第一章 总则
第一条 为规范保健食品新功能的技术评价工作,根据《中华人民共和国食品安全法》《保健食品原料目录与保健功能目录管理办法》等法律和规章,制定本细则。
第二条 保健食品新功能的技术评价工作,应当以满足消费者健康需求为宗旨,遵循促进健康、科学合理、真实可信、客观公正的原则。
第三条 任何单位或者个人(以下简称建议人)在开展相关研究的基础上,可以单独或联合向国家市场监督管理总局食品审评机构(以下简称审评机构)提出保健食品新功能建议。
新功能建议人为个人的,应当联合符合保健食品注册申请人资质的在中国境内登记的法人或者其他组织,或者上市新功能保健食品的境外生产厂商,提出保健食品新功能建议。
第四条 新功能建议纳入允许保健食品声称的保健功能目录(以下简称保健功能目录),应当通过新功能验证评价和新功能保健食品上市监测评价。
第五条 建议人应当同步研发申请新功能和申报新功能保健食品,审评机构应当同步接收新功能建议和新功能保健食品注册申请,并开展关联审评。
第二章 验证评价
第六条 新功能定位应当明确,分为补充膳食营养物质、维持或改善机体健康状况、降低疾病发生风险因素三类。
第七条 建议人开展的新功能研究和验证评价应当首先确保食用安全。新功能研究样品可以是新研发的新功能保健食品,也可以是经研究发现具有新功能的已上市的普通食品、已注册备案的保健食品等,符合保健食品注册产品的安全性、保健功能和质量可控性要求,具备开展新功能保健食品上市监测评价条件。
第八条 新功能研究应当充分开展新功能评价方法研究和方法学论证。新功能评价方法和判定标准在提出新功能建议前,应当通过至少一家具有法定资质的食品检验机构验证评价;在新功能保健食品上市监测期间,应当通过至少二家具有法定资质的食品检验机构验证评价。
第九条 新功能建议的验证评价机构应当在国家市场监督管理总局认可的具有法定资质的食品检验机构中随机选取,验证评价试验应当符合保健食品人体试验伦理审查和试验管理相关要求。
第三章 材料接收
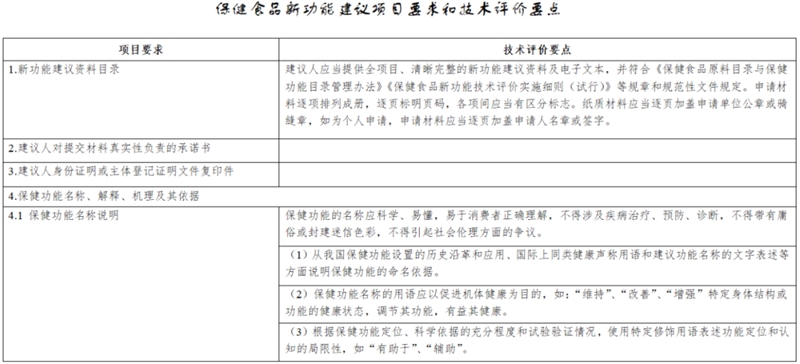
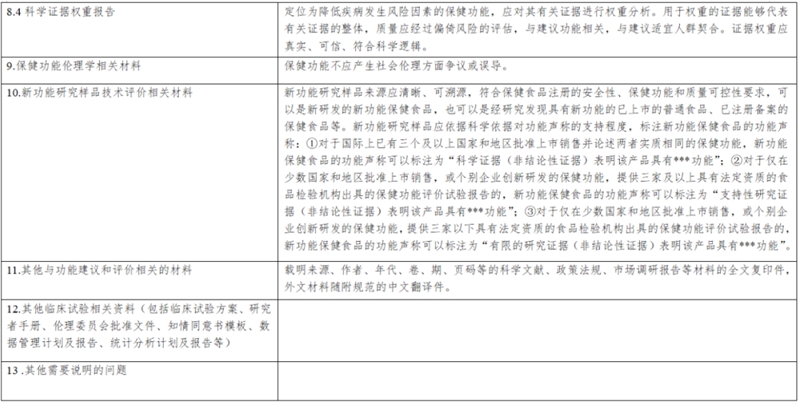
第十条 建议人提交新功能建议时,应当按照新功能建议项目要求提供全项目、清晰完整的技术评价材料及电子文本,并对提交材料的真实性负责。新功能建议项目要求见附表。
第十一条 建议材料涉及商业秘密和知识产权等情况的,建议人应当逐项标注和具体说明,并明确按照规定同意公开的内容。
第十二条 审评机构接收新功能建议材料后,符合要求的,及时组织技术评价;不符合要求的,不予接收。
第十三条 新功能保健食品的注册申请材料应当符合保健食品注册管理相关规定。
第四章 评价内容
第十四条 审评机构按照附表中的技术评价要点对新功能建议材料的下列内容进行技术评价:
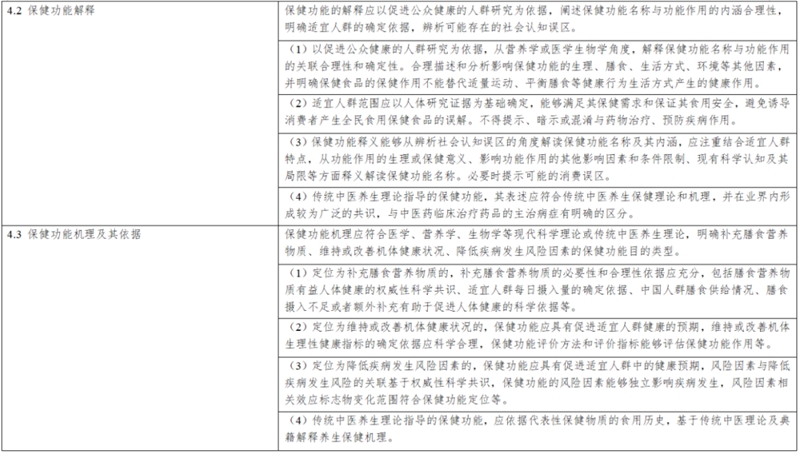
(一)保健功能名称、解释、机理以及依据;
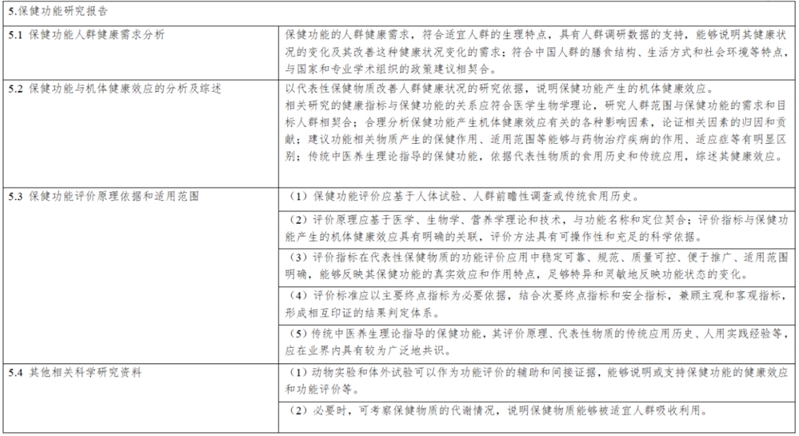
(二)保健功能研究报告,包括保健功能的人群健康需求分析,保健功能与机体健康效应的分析以及综述,保健功能试验的原理依据、适用范围,以及其他相关科学研究资料;
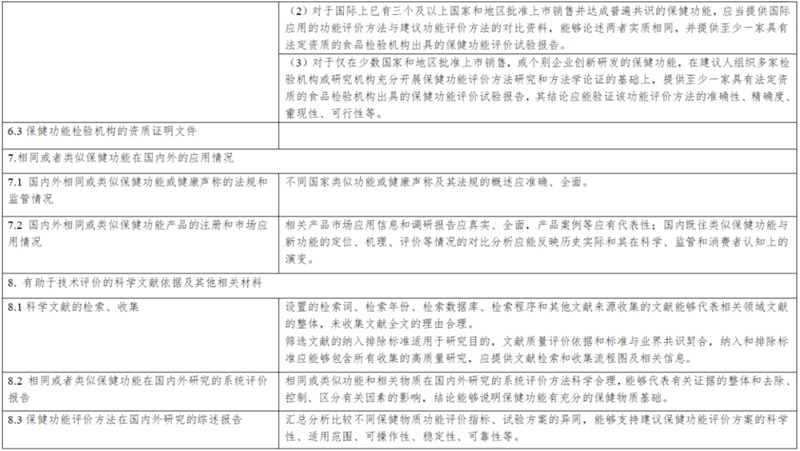
(三)保健功能评价方法和判定标准,以及评价方法和判定标准的验证评价资料;
(四)相同或者类似功能在国内外的研究应用情况;
(五)有关科学文献依据以及其他材料。
第十五条 审评机构应当对新功能验证评价开展现场核查,并可以根据需要邀请建议人对新功能的研究具体情况进行沟通交流。
第十六条 审评机构通过技术评价对新功能建议作出“建议基本符合拟纳入保健功能目录条件,需开展新功能保健食品上市监测评价”或“建议尚未符合纳入保健功能目录条件”的技术评价结论 。
第十七条 符合下列要求的,技术评价结论为“建议符合纳入保健功能目录条件,可开展新功能保健食品上市监测评价”:
(一)建议材料项目完整;
(二)不引起社会伦理学担忧;
(三)保健功能名称和解释科学合理、能够被消费者正确理解;
(四)保健功能目的明确,不涉及疾病的预防、治疗、诊断作用;
(五)保健功能人群健康需求明确;保健功能与机体健康效应的分析以及综述符合科学共识;
(六)与国外功能评价方法的对比资料和保健功能评价试验报告,能够支持保健功能评价方法和判定标准适用性、稳定性、可操作性;
(七)试验数据和文献依据充分支持研究样品符合保健食品注册申请的安全性、保健功能和质量可控性要求;
(八)以传统养生保健理论为指导的保健功能,符合传统中医养生保健理论;
(九)现场核查结论符合要求。
第十八条 审评机构应当对新功能保健食品的功能声称进行审核,根据科学依据对保健功能声称的支持程度,分类标注保健功能声称为“①科学证据/②支持性研究证据/③有限的研究证据(非结论性证据)表明该产品具有***功能”。
第十九条 新功能建议的技术评价结论为“建议符合纳入保健功能目录条件,可开展新功能保健食品上市监测评价”的,审评机构将新功能建议和新功能保健食品审评资料一并上报国家市场监督管理总局。经核准审批,新功能保健食品可以有条件上市,开展新功能保健食品上市监测评价,监测期为5年。
第二十条 出现下列情况之一的,技术评价结论为“建议不符合纳入保健功能目录条件”:
(一)建议材料内容矛盾、不符,真实性难以保证或者内容不完整,无法证实建议的科学合理性;
(二)容易引起社会伦理学担忧;
(三)保健功能名称和解释不科学、不合理、存在虚假宣传的漏洞,带有庸俗或封建迷信色彩;
(四)保健功能目的不明确,涉及疾病的预防、治疗、诊断作用;
(五)保健功能人群健康需求不明确的;保健功能与机体健康效应的分析以及综述不符合科学共识;
(六)保健功能评价方法和判定标准不适用、不稳定、不可操作;
(七)研究样品的安全性、保健功能和质量可控性不能充分支持保健功能评价试验适用性;
(八)现场核查结论不符合要求。
第二十一条 新功能建议的技术评价结论为“建议不符合纳入保健功能目录条件”的,审评机构应当告知建议人技术评价意见和结论并将新功能建议退还建议人。
第五章 监测评价
第二十二条 新功能保健食品注册证书持有人应当在监测期内开展以下新功能监测评价:
(一)制定新功能上市监测评价方案,采集产品销售、人群消费、健康评价和投诉反馈等数据,开展消费人群及健康效应的综合分析,形成年度上市监测评价自查报告,并每年报送审评机构。
(二)随机选取具有法定资质非研发验证新功能评价方法的食品检验机构开展新功能评价方法验证评价,并在监测期结束前,向审评机构提供不少于两家具有法定资质的食品检验机构出具的保健功能评价试验报告。
第二十三条 监测期内,新功能保健食品注册证书持有人未按要求开展新功能上市监测评价的,审评机构应当上报国家市场监督管理总局终止相关产品新功能上市监测评价,并撤销新功能保健食品注册证书。
第二十四条 监测期满,新功能保健食品上市监测评价符合要求的,审评机构将新功能建议技术评价结论等相关材料上报国家市场监督管理总局,依法将新功能纳入保健功能目录。
第二十五条 新功能已纳入保健功能目录,相同或实质相同的新功能保健食品的监测期自动终止,开展监测的新功能保健食品按照保健食品注册管理相关规定管理。
第六章 附则
第二十七条 审评机构为建议人提供政策解释、技术评价要求等公开咨询。
第二十八条 鼓励建议人开展新功能研究,在发布的推荐性保健功能评价方法中标注起草者名称。
第二十九条 本细则自公布之日起施行。

在线咨询